Seroprevalencia de anticuerpos anti-coronavirus felino (FCOV) en dos albergues de la ciudad de Bucaramanga
Autores
Adriana Isabel Lucena Lizarazo
M.V. – Ing. Industrial
Luis Miguel Pallares Mazzeo
M.V. – Ing. Industrial
Coautores
Karen Delgado Villamizar
M.V Msc.
Julián Ruiz-Sáenz
M.V. Msc. Phd.
Este trabajo hace parte del proyecto de Convocatoria interna de Investigación de la Universidad Cooperativa de Colombia – UCC-, entidad gestora en los ámbitos académicos y financieros del mismo.
Resumen
El presente estudio tuvo como objetivo identificar la presencia de virus de Coronavirus Felino –FCoVen 49 felinos de dos albergues de la ciudad de Bucaramanga entre junio y diciembre de 2017 a través de la aplicación de una técnica comercial de ELISA semi-cuantitativa ImmunoComb ® test, para confirmar la circulación del coronavirus felino en la ciudad, así como para evaluar el comportamiento del virus según las variables edad, sexo y estado reproductivo a través de un análisis bivariado de datos por medio de la prueba Chi 2 y test de Fisher.
Introducción
El FCoV es un agente infeccioso de distribución mundial y presentación común en lugares de hacinamiento de individuos felinos; se trasmite por contaminación fecal-oral ya que se encuentra de forma subclínica en el tracto intestinal de gatos infectados. (Bell, Toribio, White, Malik, & Norris, 2006).
Este agente afecta en mayor medida a gatos entre los 6 meses y los 2 años y los mayores de 10 años de edad; aunque no se ha demostrado una predisposición racial; sí existe una mayor incidencia en determinadas líneas genéticas y sus cruces como Sagrado de Birmania, Siamés, Persa, Bengalí, Bosque de Noruega, Scottish fold, Maine Coon, Ragdoll y British Shorthairs. Otras predisposiciones a la infección se dan en gatos machos y de estado reproductivo entero. (Arshad, 2010).
El FCoV suele causar infección de tipo gastrointestinal a menudo transitoria y asintomática, con una presentación severa en animales jóvenes, aunque también puede manifestarse en forma de una enfermedad sistémica mortal conocida como peritonitis infecciosa felina (FIP) (Barker et al., 2013). Sin embargo, el FIP sólo se desarrollará aproximadamente en el 10% de gatos seropositivos a FCoV. (Drechsler, Alcaraz, Bossong, Collisson, & Diniz, 2011).
El FCoV es un virus ARN de cadena positiva de la subfamilia Coronavirinae y género Alphacoronavirus 1. Actualmente se describen dos serotipos de FCoV: I y II. Basado en pruebas moleculares para proteína de superficie, el tipo II resulta de una recombinación entre el coronavirus tipo I y el coronavirus canino. A su vez se reportan dos biotipos, los cuales son el coronavirus felino entérico (CVEF) el cual es el responsable de la enfermedad intestinal, y el virus de la peritonitis infecciosa felina (VPIF), una enfermedad con altas tasas de mortalidad en los gatos que la desarrollan. (Sharif et al., 2010).
En la actualidad no existen estudios sobre la presencia de este agente viral en gatos ya sea en condiciones de albergue o no dentro de la región, por lo cual se vio la necesidad de realizar esta investigación con el objetivo de conocer la prevalencia de anticuerpos anti FCoV en una muestra de la población felina de la ciudad de Bucaramanga, además debido a que varias veterinarias ha reportado patologías similares a la peritonitis infecciosa felina sin prueba de la presencia del coronavirus, para esto se escogieron dos albergues de la ciudad distantes uno del otro y que reciben animales de todas las zonas geográficas de la ciudad.
Estado del arte
En un estudio de seroprevalencia del coronavirus felino en gatos ferales (grupo A), semi-callejeros (grupo B) y caseros (grupo C) en Medellín, mediante la detección de anticuerpos con el método de ELISA, de un total de 150 felinos se evidenció una seroprevalencia general de 62% (93 felinos positivos). Del grupo A, 40 felinos (62.5%) fueron positivos a la prueba serológica y 24 (37.5%) fueron negativos. En el grupo B, 43 felinos (75.43%) fueron positivos y 14 (24.56%) fueron negativos. Del grupo C, 10 individuos (34.48%) presentaron resultado positivo y 19 (65.51%) fueron negativos. De acuerdo con la distribución de los resultados entre los grupos estudiados, se reportó que en el grupo A se encontró un predominio de títulos de anticuerpos medios contra FCoV tanto para machos y hembras positivos, correspondiente a 17 machos (26.56%) y 14 hembras (21.88%), con una diferencia estadísticamente significativa (p < 0.05). En el grupo B, el nivel medio de anticuerpos contra FCoV se presentó en el mayor número de felinos positivos, a su vez en el grupo C la mayoría de los felinos presentaron resultados negativos (Ramírez et al., 2015).
Objetivos
Objetivo general
Establecer la seroprevalencia a coronavirus felino (FCoV) en dos albergues de la ciudad de Bucaramanga.
Objetivos específicos
- Determinar los anticuerpos anti-FCoV mediante un test comercial de ELISA en dos albergues felinos.
- Relacionar la presencia de anticuerpos anti-coronavirus felino con las variables: Edad, sexo, raza y estado reproductivo de la población estudio.
Metodología
Tipo de estudio
Estudio descriptivo de corte transversal

Tamaño poblacional
Para el presente estudio se utilizarán 49 felinos los cuales representan la totalidad de la población felina de dos albergues de la ciudad de Bucaramanga, distribuidos de la siguiente forma:
Albergue FUNDASIS: 25 individuos
Albergue AHURA: 24 individuos
Criterios de inclusión
Felinos, sin discriminación de sexo y raza, edad y estado reproductivo.
Recolección de la información
De la totalidad de los felinos incluidos en el estudio, se realizará una inspección visual para determinar el sexo y la raza, variables como edad y estado reproductivo se obtendrán a través de los registros aportados por cada albergue.
Lugar de ejecución
El estudio se llevará a cabo en dos sitios de albergue felino ubicados en la zona urbana del municipio de Bucaramanga (Santander).
Toma de muestras
Muestras Sanguíneas
Se tomó 1 ml de sangre a través de venopunción cefálica o femoral con agua calibre 22 de 1½ pulgada. La muestra se recolectó en tubos secos y se dejó coagular a temperatura ambiente. Posterior se procedió a centrifugar a 5000 rpm por 15 minutos.
Aplicación prueba rápida detección de anticuerpos
Esta se realizó por medio de una técnica ELISA semi-cuantitativa ImmunoComb® test, la cual es un ELISA modificado (Dot ELISA).
Resultados
Resultados de positividad para Kit Immunocomb®
Siguiendo las indicaciones del fabricante para análisis de resultados de las 49 muestras evaluadas, se evidenció que el 83,7% (n=41) de las muestras fueron positivas y el 16,3 (n=8) fueron negativas. Por la distribución de los datos según los parámetros de la tabla 1, se evidenció que el 16,3% (n=8) se encontraba entre S0 y <S1, el 12,2% (n=6) entre S2 y ≥S3, y entre S4 y S6 el 71,4% (n=35).
Seroprevalencia
A través del programa en línea Working en Epidemiology®, disponible en http://www.winepi.net , se calculó la prevalencia aparente en la población, siendo de 83.67%, teniendo en cuenta la sensibilidad (S) y la especificidad (E) de la prueba de diagnóstico ImmunoComb® Feline Coronavirus reportada por la casa comercial [S 92,3% E 99.99%] se concluyó la prevalencia real del 90.65%.
Variable Sexo
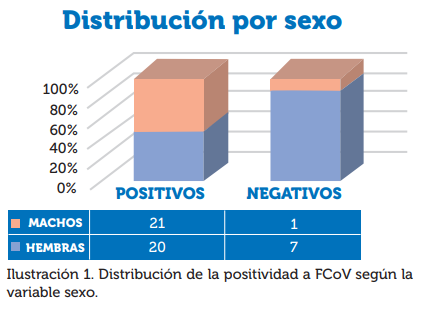
En la evaluación por sexo se encontró que el 95% de los machos y el 74% de las hembras fueron positivas para FCoV. Como se muestra en la ilustración 1. Para la prueba de Chi2 se evidenció una diferencia estadística de P=0,04, indicando que no hay relación entre el sexo del animal y la presencia de la enfermedad. Ver Tabla 1.
Distribución por sexo

Datos: El objetivo es ver si las variables cualitativas PRUEBA y SEXO están significativamente asociadas.
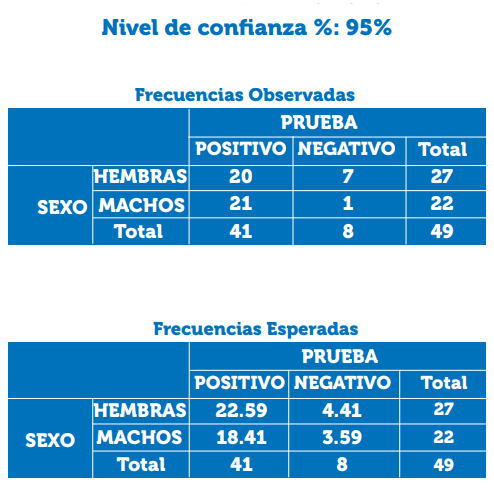
Resultados: con los datos introducidos la significación calculada para la prueba chi-cuadrado (x 2) no es válida

Nota: La significación de la x 2 no es válida ya que el 50.0% de los resultados esperados son menos de 5.
Imagen 1. Valores de para variable SexoEstado Reproductivo. Tomado de:
http://www.winepi.net
Variable Rango Etario
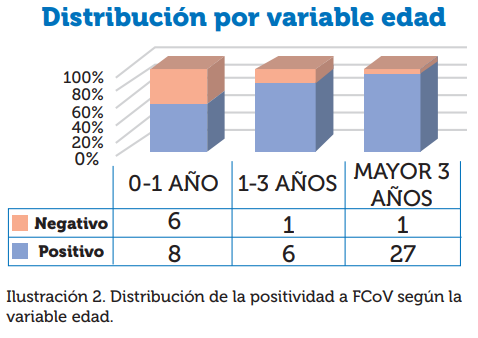
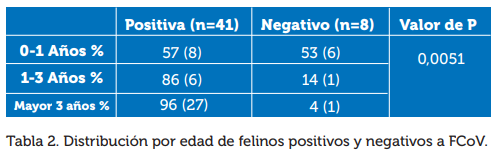
Según su grupo etario, se evidencia que los animales positivos representan un porcentaje del 57% de los menores de un año, el 86% entre el grupo de 1 a 3 años y el 96% del grupo de mayores de 3 años.
En la prueba Chi2 se evidenció una significancia estadística de P=0.051, indicando que no ha relación significativa entre la variables de los grupos etarios y la presencia del FCoV, como se muestra en la ilustración 2 y tabla 2.
Estadística básica: prueba de chi-cuadrado (3)
Datos: El objetivo es ver si las variables cualitativas PRUEBA y RANGO ETARIO están significativamente asociadas:
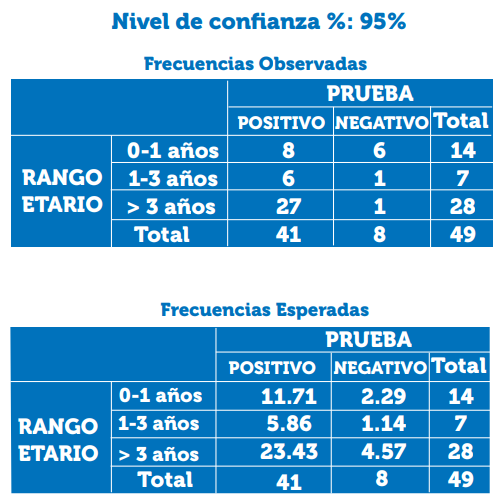
Resultados: Con los datos introducidos la significación calculada para la prueba Chi-cuadrado (X2) no es válida.

Imagen 2. Valores de para variable rango etario. Tomado de: http://www.winepi.net
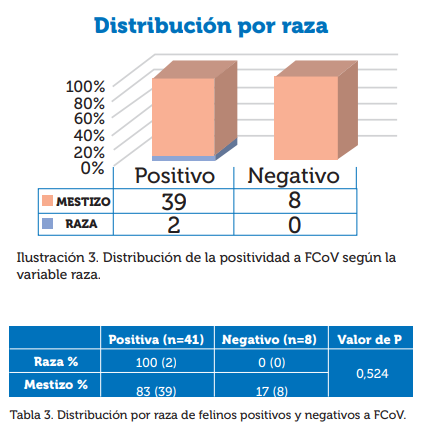
Variable Raza
De los individuos en estudio, el 83% del grupo de mestizos fueron positivos a FCoV, esto en contraste con los individuos del grupo de raza, de los cuales el 100% fueron igualmente positivos, como se muestra en la ilustración 3 y tabla 3. Se debe tener en cuenta la desigualdad en la población donde solo dos de los 49 individuos evaluados eran de raza, por lo cual las diferencias estadísticas no permiten correlacionar las variables.
Estadística básica: prueba de Chi-cuadrado (3)
Datos: El objetivo es ver si las variables cualitativas PRUEBA y RAZA están significativamente asociadas.
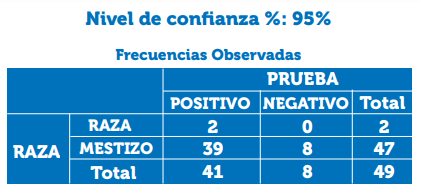
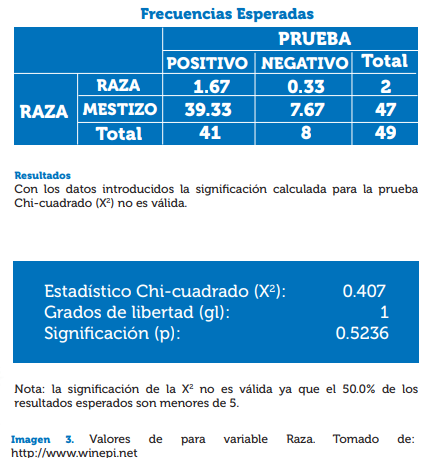
Imagen 3. Valores de para variable Raza. Tomado de: http://www.winepi.net
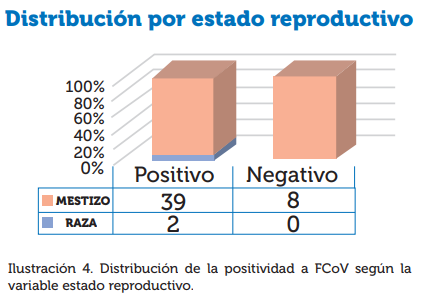
Variable Estado Reproductivo
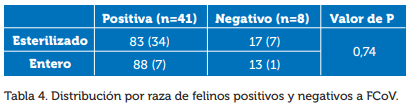
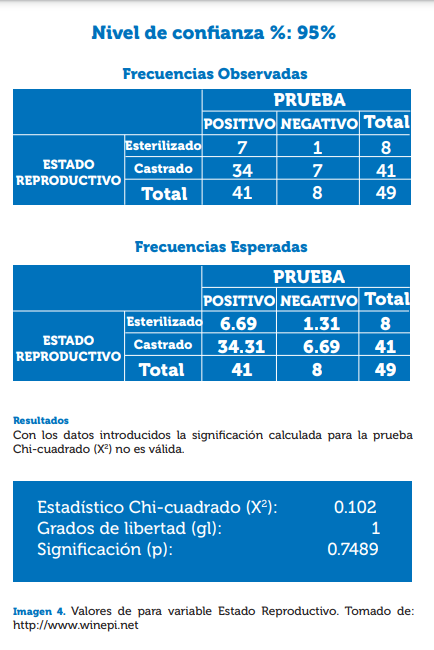
Para la variable estado reproductivo, se encontró que el 83% de individuos esterilizados fueron positivos a FCoV, en comparación al 88% de los animales enteros reproductivamente, como se muestra en la ilustración 4 y tabla 4. Para esta variable no se evidenció diferencias estadísticas siendo P=0,74. Lo que indica que no hay relación entre la variable del estado reproductivo y la presencia de la enfermedad.
Estadística Básica: Prueba de Chi-Cuadrado (3)
Datos: el objetivo es ver si las variables cualitativas PRUEBA y ESTADO REPRODUCTIVO están significativamente asociadas:
Discusión
Se muestran los datos de gatos en condiciones de hacinamiento de dos albergues de la ciudad de Bucaramanga, a través de mediciones de anticuerpos con prueba comercial, se revela un alto porcentaje de individuos infectados, llegando a una seroprevalencia del 90.65%, lo que refleja que aproximadamente 9 de cada 10 gatos es portador y se encuentra diseminando el agente y está en riesgo de desarrollar FIP.
La presencia de FCoV suele ser mayor en los gatos de albergues frente a los domiciliarios, basados en la epidemiología de la enfermedad, donde el contacto íntimo favorece la trasmisión fecal-oral.
Estudios han evidenciado mayores porcentajes de infección en animales mantenidos en hogares de albergue, frente a felinos de hogares individuales, a pesar de que esta diferencia no fue significativa estadísticamente. (Kummrow et al., 2005). Este comportamiento epidemiológico también se muestra en un estudio realizado en la Ciudad de Medellín, donde se encontró una mayor prevalencia serológica en gatos de albergue comparado con los gatos de casa sin encontrar diferencias estadísticas entre estos dos grupos y con una prevalencia real del 84% (Ramírez et al., 2015).
La identificación de anticuerpos es una herramienta útil como indicador de infección asintomática, por lo cual debería ser una medida de control en albergues antes de introducir un nuevo individuo y debería tenerse en cuenta en el manejo de albergues felinos.
El kit comercial InmunoComb®, utilizado en el presente estudio, se interpreta según la escala de manchas grises y las indicaciones de la casa comercial, (ver figura 2) Los resultados son proporcionados en una escala de 1-6, las cuales fueron interpretadas por dos de los investigadores buscando disminuir la subjetividad siguiendo las instrucciones de la casa comercial y los resultados reportados por (Diane D. Addie et al., 2004). interpretadas por dos de los investigadores buscando disminuir la subjetividad siguiendo las instrucciones de la casa comercial y los resultados reportados por (Diane D. Addie et al., 2004).
La totalidad de la población felina estudiada no presentaba signos clínicos al momento del muestreo, esto fue determinado a través de un examen clínico semiológico realizado por el equipo investigador, lo cual contrasta con el alto número de animales seropositivos. Lo anterior concuerda con investigaciones que mostraron que un alto porcentaje (71%), de gatos sin síntomas de FIP en ambientes expuestos fueron positivos para FCoV. (D. D. Addie et al., 2003; Herrewegh, Smeenk, Horzinek, Rottier, & de Groot, 1998). Así mismo, las fases clínicas del FIP, se desarrollan en el 10% de los animales infectados, y la forma de CVEF, es más prevalente en animales jóvenes cachorros y se manifiesta por enteritis leve y autolimitante.(Carolina de Alvarenga Cruz et al., 2013).
De acuerdo con el análisis por variables, se encontró que el 95% de los machos y el 74% de las hembras fueron positivas para FCoV, con una diferencia estadística de P=0,04. Lo anterior concuerda con lo reportado por (Benetka et al., 2004) quien mostró que la incidencia de FIP fue significativamente mayor en los machos que en hembras (P=0,035), aunque no existe una correlación con diferencias hormonales, pero si con comportamiento propio de los machos lo que los hace tener mayor riesgo de infección. (Taharaguchi, Soma, & Hara, 2012) reportan un 63,3% de machos positivos sin diferencias significativas en comparación con el porcentaje de hembras positivas que fue menor.
Según la variable edad, se evidencia que el grupo etario de >3 años presentó un mayor porcentaje de individuos positivos a FCoV, con el 86%. Este resultado puede asociarse a múltiple factores como: mayor tiempo en el albergue, mayor exposición a infecciones, al igual que situaciones de estrés propias de las condiciones de hacinamiento que genera competencia por espacio y alimentación (Pesteanu-Somogyi et al., 2006).
De los individuos en este estudio el 83% del grupo de mestizos fueron positivos a FCoV, esto en contraste con los individuos del grupo de raza, de los cuales el 100% fueron igualmente positivos.
Diversos estudios avalan resultados similares donde el porcentaje de gatos de raza positivos a FCoV era superior (P≤ 0,001). (Benetka et al., 2004; Pesteanu-Somogyi et al., 2006). Esta susceptibilidad para el FIP en gatos de raza puede ser atribuida a la endogamia genética y a la predisposición, que puede haber evolucionado en ciertas razas de gatos (Benetka et al., 2004).
En la presente investigación no se pudo realizar una correlación exitosa de la variable raza, dado que al ser albergues de animales callejeros, la mayoría son animales mestizos, los tres individuos de raza que se pudieron evaluar pertenecían a angora y siamés. (Pesteanu-Somogyi et al., 2006) reportó una prevalencia de FIP en gatos de raza mixta del 0,35% frente a 1,3% en raza pura. Las razas con una mayor prevalencia de la FIP fueron: el Abisinio, Bengalí, Sagrado de Birmania, Himalaya, Ragdoll, y Rex, y atribuye estos hallazgos a que los gatos de raza pura son más propensos a provenir de criaderos, los cuales son entornos estresantes y de hacinamiento lo que favorece la circulación del virus.
Según la variable estado reproductivo, se encontró que los porcentajes de seropositividad eran similares para individuos esterilizados en comparación con individuos enteros, con el 83% y 88% respectivamente, sin diferencias estadísticas (P≤0,05). Esta variable ha sido poco investigada, encontrándose solo un estudio por (Benetka et al., 2004), quien afirma que el papel de las diferencias sexuales en el sistema inmunológico, en particular en la inmunidad mediada de las células y la importancia de estos factores en los animales esterilizados y la influencia hormonal en la infección por FCoV todavía no son claras.
Conclusiones
- Se estableció una seroprevalencia de 90,65% a coronavirus felino (FCoV) para la totalidad de la población de gatos provenientes de dos albergues de la ciudad de Bucaramanga, mediante un test comercial de ELISA.
- Se evidenció que los machos felinos evaluados poseen una tendencia mayor a infectarse por el FCoV, respecto a las hembras.
- De acuerdo con la edad, se encontró menor porcentaje de seropositividad en el grupo de menores de 1 año, existiendo una diferencia estadística significativa entre el grupo de >3 años frente a la infección con el virus.
- La variable raza no se pudo correlacionar exitosamente, dado que el 97% de la población evaluada era de raza mestiza. De igual forma se evidenció que los porcentajes de animales seropositivos de acuerdo al estado reproductivo eran muy similares.
- Aunque no se puede determinar la seroprevalencia de la enfermedad en el Área metropolitana de Bucaramanga, la presencia del virus dentro de dos albergues aislados geográficamente y con animales provenientes de diferentes partes del municipio y sus alrededores, es un indicativo de que el virus FCoV se encuentra latente en la población felina del Municipio.
Bibliografia
Addie, D. D., le Poder, S., Burr, P., Decaro, N., Graham, E., Hofmann-Lehmann,
R., … Meli, M. L. (2015). Utility of feline coronavirus antibody tests, Utility of feline
coronavirus antibody tests. Journal of Feline Medicine and Surgery, 17(2), 152–162.
https://doi.org/10.1177/1098612X14538873
Addie, D. D., McLachlan, S. A., Golder, M., Ramsey, I., & Jarrett, O. (2004).
Evaluation of an inpractice test for feline coronavirus antibodies. Journal of Feline
Medicine & Surgery, 6(2), 63–67. https://doi.org/10.1016/j.jfms.2004.01.001
Addie, D. D., Schaap, I. A. T., Nicolson, L., & Jarrett, O. (2003). Persistence and
transmission of natural type I feline coronavirus infection. Journal of General
Virology, 84(10), 2735–2744. https://doi.org/10.1099/vir.0.19129-0
Alarcón, Gabriela Verónica, Paludi, Alejandro Esteban, & Nejamkin, Pablo. (2016).
Actualización sobre las bases terapéuticas para la Peritonitis Infecciosa Felina (PIF)
y presentación de tres casos clínicos de PIF tratados con Talidomida. (Pregrado).
Facultad de Ciencias Veterinarias -UNCPBA, Tandil, Argentina. Retrieved from http://
www.ridaa.unicen.edu.ar/xmlui/bitstream/handle/123456789/607/ Tesis%20
Alarcon%2 C%20Gabriela%20Ver%C3%B3nica.pdf?sequence=1&isAllowed=y
Amer, A., Siti Suri, A., Abdul Rahman, O., Mohd, H. B., Faruku, B., Saeed, S.,
& Tengku Azmi, T. I. (2012). Isolation and molecular characterization of type I
and type II feline coronavirus in Malaysia. Virology Journal, 9, 278. https://doi.
org/10.1186/1743-422X-9-278
An, D.-J., Jeoung, H.-Y., Jeong, W., Park, J.-Y., Lee, M.-H., & Park, B.-K. (2011).
Prevalence of Korean cats with natural feline coronavirus infections. Virology
Journal, 8, 455–455. https://doi.org/10.1186/1743-422X-8-455
Arshad, S. S. (2010). Prevalence of feline coronavirus. Journal of Feline Medicine
and Surgery, 12(4), 360–360. https://doi.org/10.1016/j.jfms.2009.11.005
(Auth.), J. E. S. (2013). Canine and Feline Infectious Diseases. Retrieved from
http://gen.lib.rus.ec/book/index.php?md5=72ec19f0a59c25d4157a7ffc006aa804
Barker, E. N., Tasker, S., Gruffydd-Jones, T. J., Tuplin, C. K., Burton, K., Porter,
E., … Siddell, S.G. (2013). Phylogenetic analysis of feline coronavirus strains in an
epizootic outbreak of feline infectious peritonitis. Journal Of Veterinary Internal
Medicine, 27(3), 445–450. https://doi.org/10.1111/jvim.12058
Bell, E. T., Toribio, J. a. L. M. L., White, J. D., Malik, R., & Norris, J. M. (2006).
Seroprevalence study of feline coronavirus in owned and feral cats in Sydney,
Australia. Australian Veterinary Journal, 84(3), 74–81.
Benetka, V., Kübber-Heiss, A., Kolodziejek, J., Nowotny, N., Hofmann-Parisot, M.,
& Möstl, K.(2004). Prevalence of feline coronavirus types I and II in cats with
histopathologically verified feline infectious peritonitis. Veterinary Microbiology,
99(1), 31–42. https://doi.org/10.1016/j.vetmic.2003.07.010
Cardoso, D. P. (2007). Relação entre albumina e globulina na efusão de gatos
suspeitos de peritonite infecciosa felina (PIF). Retrieved from http://www.lume.
ufrgs.br/handle/10183/13237
Carolina de Alvarenga Cruz, Fernanda Cassioli de Moraes, Raphaella Barbosa
Meirelles-Bartoli, & Daniel Bartoli de Sousa. (2013). Aspectos epidemiológicos
da peritonite infecciosa felina. PUBVET, Publicações Em Medicina Veterinária
E Zootecnia., 7(14). Retrieved from http://www.pubvet.com.br/uploads/
c104048124d0a54e6547f189adb9ef90.pdf
Dewerchin, H. L., Cornelissen, E., & Nauwynck, H. J. (2005). Replication of feline
coronaviruses in peripheral blood monocytes. Archives Of Virology, 150(12), 2483–
2500.
Diane D. Addie, McLachlan, S. A., Matthew Golder, Ian, Ian, Ramsey, & Oswald
Jarretta. (2004). Evaluación del test de anticuerpos frente al Coronavirus felino
ImmunoComb FCoV. Journal of Feline Medicine and Surgery, 6(6), 67.
Drechsler, Y., Alcaraz, A., Bossong, F. J., Collisson, E. W., & Diniz, P. P. V. P.
(2011). Feline Coronavirus in Multicat Environments. Veterinary Clinics of North
America: Small Animal Practice, 41(6), 1133–1169. https://doi.org/10.1016/j.
cvsm.2011.08.004
Gomez, M., & Jose, M. (2016). Investigaciones recientes en peritonitis infecciosa
felina. Retrieved from http://repository.ucc.edu.co/handle/ucc/4915 Hartmann,
K., Binder, C., Hirschberger, J., Cole, D., Reinacher, M., Schroo, S., … Hermanns,
W. (2003). Comparison of different tests to diagnose feline infectious peritonitis.
Journal of Veterinary Internal Medicine, 17(6), 781–790.
Herrewegh, A. A. P. M., Smeenk, I., Horzinek, M. C., Rottier, P. J. M., & de Groot,
R. J. (1998). Feline Coronavirus Type II Strains 79-1683 and 79-1146 Originate
from a Double Recombination between Feline Coronavirus Type I and Canine
Coronavirus. Journal of Virology, 72(5), 4508–4514.
Hohdatsu, T., Okada, S., Ishizuka, Y., Yamada, H., & Koyama, H. (1992). The
prevalence of types I and II feline coronavirus infections in cats. The Journal of
Veterinary Medical Science, 54(3), 557–562.
Holst, B. S., Englund, L., Palacios, S., Renström, L., & Berndtsson, L. T. (2016).
Prevalence of antibodies against feline coronavirus and Chlamydophila felis in
Swedish cats: Journal of Feline Medicine and Surgery. https://doi.org/10.1016/j.
jfms.2005.12.004
Jaimes, J. A., & Whittaker, G. R. (2018). Feline coronavirus: Insights into viral
pathogenesis based on the spike protein structure and function. Virology. https://
doi.org/10.1016/j.virol.2017.12.027
Johann, J. M., Caetano, C. F., Hass, R., Guim, T. N., Fischer, G., Vargas, G. D., …
Hübner, S. O. (2009). Serum survey for antibodies to coronavirus, herpesvirus,
calicivirus, and parvovirus in domestics cats from Rio Grande do Sul, Brazil.
Arquivo Brasileiro de Medicina Veterinária E Zootecnia, 61(3), 752–754. https://
doi.org/10.1590/S0102-09352009000300033
Kummrow, M., Meli, M. L., Haessig, M., Goenczi, E., Poland, A., Pedersen, N.
C., … Lutz, H. (2005). Feline coronavirus serotypes 1 and 2: seroprevalence
and association with disease in Switzerland. Clinical and Diagnostic Laboratory
Immunology, 12(10), 1209–1215. https://doi.org/10.1128/CDLI.12.10.1209-
1215.2005
Monteleone, G. S., Brandão, P. E., Demétrio, C., Gregori, F., Rosa, C., Rosales, C.
a. R., … Jerez, J. A. (2008). DETECÇÃO DO VÍRUS DA PERITONITE INFECCIOSA
FELINA (FIPV) POR MEIO DA PCR. Ars Veterinaria, 21(1), 30–33. https://doi.
org/10.15361/2175-0106.2005v21n1p30-33
Myrrha, L. W. (2011). Filogenia e filogeografia do Feline coronavirus (FCoV) em
gatos domésticos (Felis catus) naturalmente infectados. Retrieved from http://
www.locus.ufv.br/handle/123456789/5074
Pesteanu-Somogyi, L. D., Radzai, C., & Pressler, B. M. (2006). Prevalence of
feline infectious peritonitis in specific cat breeds. Journal of Feline Medicine and
Surgery, 8(1), 1–5. https://doi.org/10.1016/j.jfms.2005.04.003
Pratelli, A. (2008). Comparison of Serologic Techniques for the Detection
of Antibodies against Feline Coronaviruses. Journal of Veterinary Diagnostic
Investigation, 20(1), 45–50. https://doi.org/10.1177/104063870802000108
Ramírez, I. D., Hernández, C. A., Ramírez, R., & Velásquez, M. A. (2015). Estudio
de seroprevalencia del coronavirus felino en gatos callejeros, de albergue y caseros
en Medellín durante el 2013. (Spanish). Biomédica: Revista Del Instituto Nacional
de Salud, 35, 73–73.
Rottier, P. J. M., Nakamura, K., Schellen, P., Volders, H., & Haijema, B. J.
(2005). Acquisition of Macrophage Tropism during the Pathogenesis of Feline
Infectious Peritonitis Is Determined by Mutations in the Feline Coronavirus Spike
Protein. Journal of Virology, 79(22), 14122–14130. https://doi.org/10.1128/
JVI.79.22.14122-14130.2005
Rubio V., A., & Chavera C., A. (2018). Peritonitis infecciosa felina: dos casos
clínicos en Lima-Perú. Revista de Investigaciones Veterinarias Del Perú, 29(1),
- https://doi.org/10.15381/rivep.v29i1.14188
Salamanca, C. A., Polo, L. J., & Vargas, J. (2011). SOBREPOBLACIÓN CANINA
Y FELINA: TENDENCIAS Y NUEVAS PERSPECTIVAS. Revista de La Facultad de
Medicina Veterinaria Y de Zootecnia, 58(1), 45–53.
Sharif, S., Arshad, S. S., Hair-Bejo, M., Omar, A. R., Zeenathul, N. A., & Alazawy,
A. (2010). Diagnostic Methods for Feline Coronavirus: A Review. Veterinary
Medicine International, 2010, 1–7. https://doi.org/10.4061/2010/809480
S.S.Arshadi, Lee, W. W., L. Hassanl, M.Kamarudinl,A, A. I., W. Sitl-Farawahida,
& N.A.B.Y. Cheng’. (2004). SEROLOGICAL SURVEY OF CATTERIES FOR CATS
INFECTED WITH FELINE CORONAVIRUS. J. Vet. Malaysia, 17(1), 19–22.
Taharaguchi, S., Soma, T., & Hara, M. (2012). Prevalence of feline coronavirus
antibodies in Japanese domestic cats during the past decade. The Journal of
Veterinary Medical Science, 74(10), 1355–1358.
Terada, Y., Matsui, N., Noguchi, K., Kuwata, R., Shimoda, H., Soma, T., …
Maeda, K. (2014). Emergence of pathogenic coronaviruses in cats by homologous
recombination between feline and canine coronaviruses. Plos One, 9(9), e106534–
e106534. https://doi.org/10.1371/journal.pone.0106534









