Eficacia de afoxolaner y afoxolaner más milbemicina oxima frente a perros naturalmente infestados con Rhipicephalus sanguineus sensu lato en cuatro diferentes zonas en Colombia
Molina, V1*; Pérez-Suárez, D1; Prada J2; Pérez-Cogollo JC3, Pedraza, N4
1 Boehringer Ingelheim. 2 Universidad de Medellín. 3 Universidad de Córdoba. 4 Universidad de los Llanos.
Introducción
La garrapata marrón del perro (Rhipicephalus sanguineus) sensu lato (sl) es uno de los vectores más importantes de hemoparásitos en caninos (Chomel, 2011; Gray et al., 2013; Maggi & Krämer, 2019; Otranto et al., 2009). A su vez, es la especie de garrapata más extendida en el mundo y está altamente adaptada a las condiciones climáticas de humedad o sequía en zonas tropicales y subtropicales, pero también, puede prosperar en climas templados donde el calentamiento global contribuye a su mayor presencia (Day, 2011). R. sanguineus sensu lato es la responsable del mantenimiento y la transmisión de múltiples patógenos a los animales domésticos y al ser humano (Dantas-Torres, 2010; Tielemans et al., 2021). Por lo tanto, el control de las infestaciones por garrapatas es un método para disminuir la pérdida de sangre, la irritación que generan cuando se alimentan y reducir el riesgo de transmisión de hemoparásitos (Allen et al., 2020; Boulanger et al., 2019).
De acuerdo con la agencia europea de medicamentos (EMA) los acaricidas deben demostrar una eficacia de al menos el 90% en las primeras 48h posteriores al tratamiento, debido a que el mecanismo de acción sobre los artrópodos es sistémico, teniendo primero que adherirse y alimentarse para posteriormente morir, lo que reduce en gran medida las posibilidades de transmisión de patógenos por parte de las garrapatas, (EMA, 2021; Halos et al., 2012; Marchiondo et al., 2013; Pfister & Armstrong, 2016). El afoxolaner es una molécula novedosa perteneciente a la familia de las isoxazolinas con acción insecticida-acaricida que actúa sobre el receptor del ácido γ-aminobutírico (GABA) y los receptores de glutamato de los insectos, generando un exceso de estimulación neuronal y la muerte del artrópodo (Gassel et al., 2014; Lahm et al., 2013; Shoop et al., 2014) Afoxolaner es el ingrediente activo de NexGard® una tableta masticable de alta palatabilidad, con una dosis mínima efectiva de 2.5 mg/kg de peso vivo (pv), ha demostrado buena efectividad frente a múltiples ectoparásitos del perro por al menos 30 días (Dumont et al., 2014; Kondo et al., 2014; Six et al., 2016). Recientemente se ha registrado NexGard Spectra®, una tableta masticable que combina afoxolaner y milbemicina oxima con dosificación de 2.5 mg/kg pv y 0.5mg/kg pv respectivamente. Capaz de controlar las infestaciones de pulgas, garrapatas, nemátodos intestinales y el nematodo del corazón (Dirofilaria immitins)(Fankhauser et al., 2016; Hampel et al., 2018; Romero-Núñez et al., 2020). El objetivo de este estudio es proporcionar una comparación de la eficacia entre afoxolaner (NexGard® Boehringer Ingelheim) y afoxolaner más Milbemicina (NexGard Spectra® Boehringer Ingelheim) frente a Rhipicephalus sanguineus sl en perros naturalmente infestados en 4 diferentes zonas de Colombia.
Materiales y métodos
Este estudio fue aprobado bajo Comité de Ética para la Experimentación con Animales de la Universidad de Antioquia, acta 140, del 01 de junio del 2021. Los procedimientos del estudio se ajustaron a las directrices de la Asociación Mundial para el Avance de la Parasitología Veterinaria (WAAVP) con el fin de evaluar la eficacia de los parasiticidas frente al tratamiento, la prevención y el control de la infestación por pulgas y garrapatas en perros y gatos (Marchiondo et al., 2013). Este es un estudio de tipo multicéntrico, se realizó entre los meses de abril y julio del 2021 en 4 diferentes departamentos de Colombia; Antioquia, Córdoba, Meta y Santander, en donde la temperatura promedio fue de 28° C, condiciones óptimas para la presencia de la garrapata marrón del perro (Rhipicephalus sanguineus) sl (Dantas-Torres, 2010).
Animales Se seleccionaron 80 caninos de raza mestizo con altas cargas de garrapatas R. sanguineus sl confirmadas taxonómicamente por laboratorio de parasitología, los criterios de inclusión fueron perros clínicamente sanos de cualquier sexo o raza, con un peso no menor a 2 kg y mayores a 8 semanas de edad con infestación natural por garrapatas del género Rhipicephalus sanguineus, sin historial de tratamiento para ectoparásitos en los últimos 3 meses. Los perros incluidos fueron perros sin propietario, mantenidos en perreras a lo largo del estudio, a excepción de Villavicencio, Meta en donde los perros fueron mantenidos en la Universidad de los llanos, con disponibilidad de alimento y agua. Los profesionales se trasladaron a la ubicación en donde se encontraban los perros para realizar los conteos de garrapatas en los diferentes tiempos de evaluación; 0 horas (T0), 12h (T1), 24h (T2), 48h (T3), 7d (T4), 14d (T5), 21d (T6) y 30d (T7).
Tratamiento. Los perros fueron divididos de manera aleatoria en dos grupos de tratamiento, A y B, el grupo A recibió afoxolaner (NexGard®) a dosis mínima efectiva de 2,5mg/kg pv vía oral (VO), única dosis n= 40, el grupo B recibió afoxolaner más milbemicina oxima (Nexgard Spectra®)a una dosis mínima efectiva de 2.5 mg/kg pv VO y 0.5 mg/kg respectivamente única dosis n=40.
Conteo de garrapatas el conteo inicial de garrapatas, previo al tratamiento (T0), se tomó como control (Forster et al., 2021), posteriormente se administró el tratamiento a los dos grupos y se realizaron conteos de garrapatas a las 12h, 24h, 48h, 7d, 14d, 21d y 30d para evaluar la eficacia de los dos tratamientos. El recuento de garrapatas vivas se realizó separando y palpando el pelaje del perro con las yemas de los dedos, con ayuda de una lámpara pielítica (Marchiondo et al., 2013). Cuando se encontró una sospecha de garrapata, se separó aún más el pelo y se confirmó visualmente la presencia de la garrapata sin retirar la garrapata, Ilustración 1, 2.
El género y especie de la garrapata (Rhipicephalus sanguineus) se determinó taxonómicamente en el laboratorio de parasitología de la Universidad de los llanos, Universidad de Córdoba.
Evaluación de seguridad.
Todos los perros que recibieron alguno de los dos tratamientos se incluyeron en la evaluación de seguridad del producto. Cada uno de los perros enrolados en el estudio recibieron un examen físico por parte de un veterinario previo al tratamiento inicial (T0) y en los subsecuentes tiempos de evaluación.
Análisis estadístico.
El número de garrapatas vivas (adheridas y no adheridas) fue la variable principal del estudio (Packianathan et al, 2020). El porcentaje de efectividad se calculó mediante la media aritmética (MA) de garrapatas vivas de los grupos para cada día pre y post tratamiento (T0, T1, T2, T3, T4, T5, T6 Y T7). Se usó la fórmula de Abbott para el cálculo de eficacia:
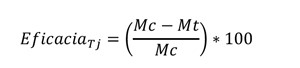
Donde Mc es media aritmética de garrapatas vivas en T0 y Mt es la media aritmética de garrapatas vivas después del tratamiento para cada tiempo. (Becskei et al., 2016).
El análisis se realizó en el programa estadístico Stata 17, considerando una significancia estadística (p<0,05).
Resultados
Un total de 80 perros fueron reclutados y tratados en 4 zonas de Colombia, donde la presencia de garrapatas es endémica. La distribución de caninos por departamento de Colombia fue así; para Antioquia n= 20, Córdoba n= 20, Santander n=20 y Meta n=20. Los perros tratados con afoxolaner (NexGard® Boehringer Ingelheim) n= 40 y afoxolaner más milbemicina oxima (NexGard Spectra® Boehringer Ingelheim) n= 40, no mostraron ningún efecto no deseado relacionado al tratamiento.
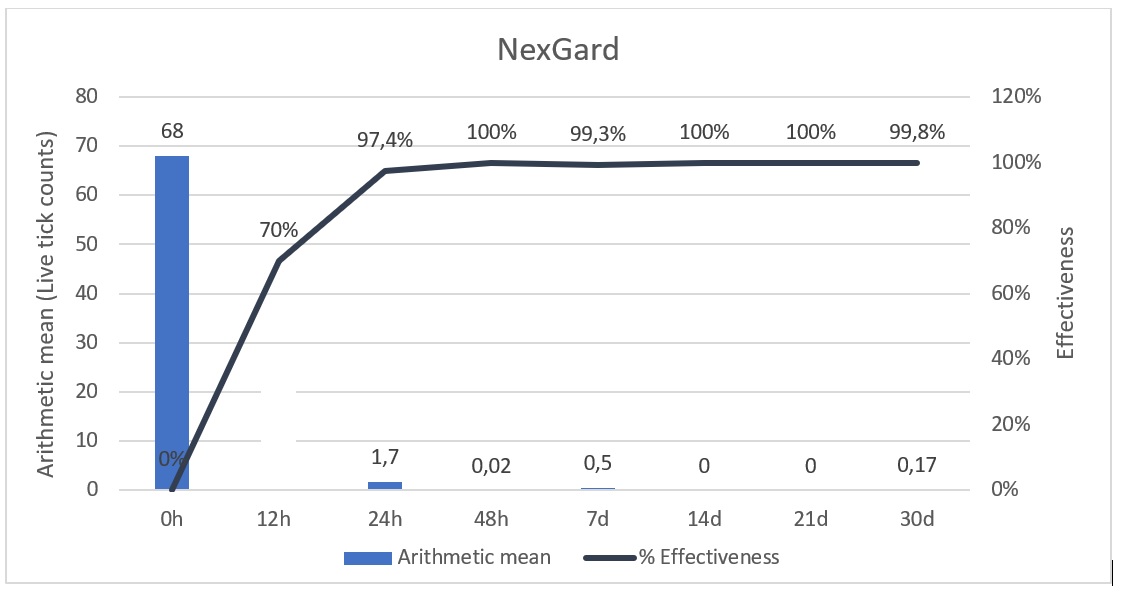
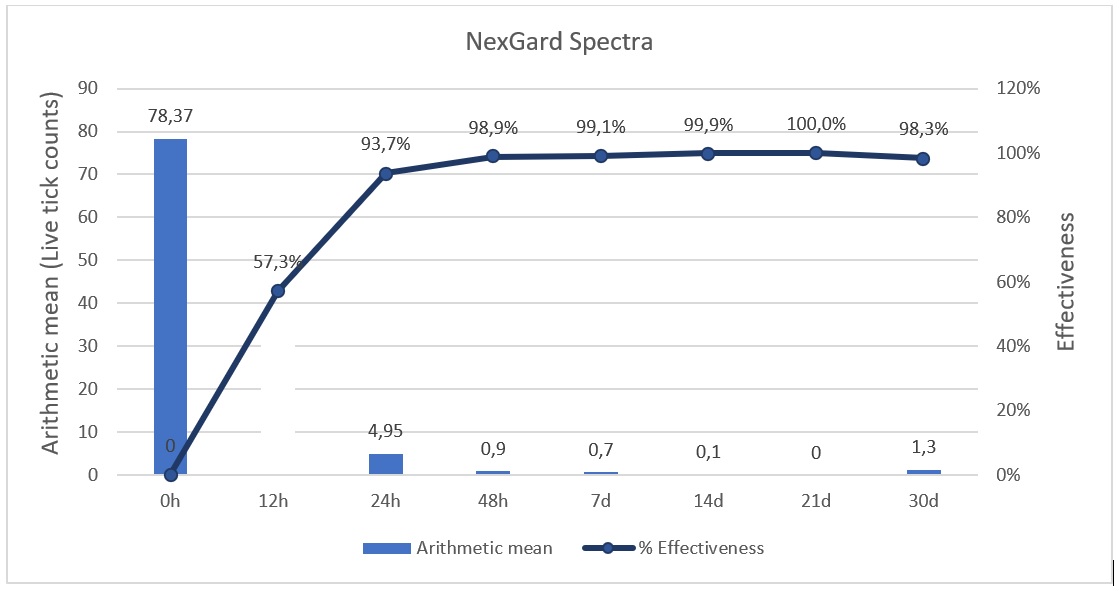
La media aritmética (MA) de garrapatas vivas y el porcentaje de efectividad se encuentran en la Table 1. La MA para el grupo A en el tiempo 0 fue de 68 garrapatas vivas, y para el grupo B la MA fue 78,37 Figure 1; no se pudo encontrar diferencia estadística significativa (p≤0.05) entre el número inicial de garrapatas vivas para el grupo A y el B.
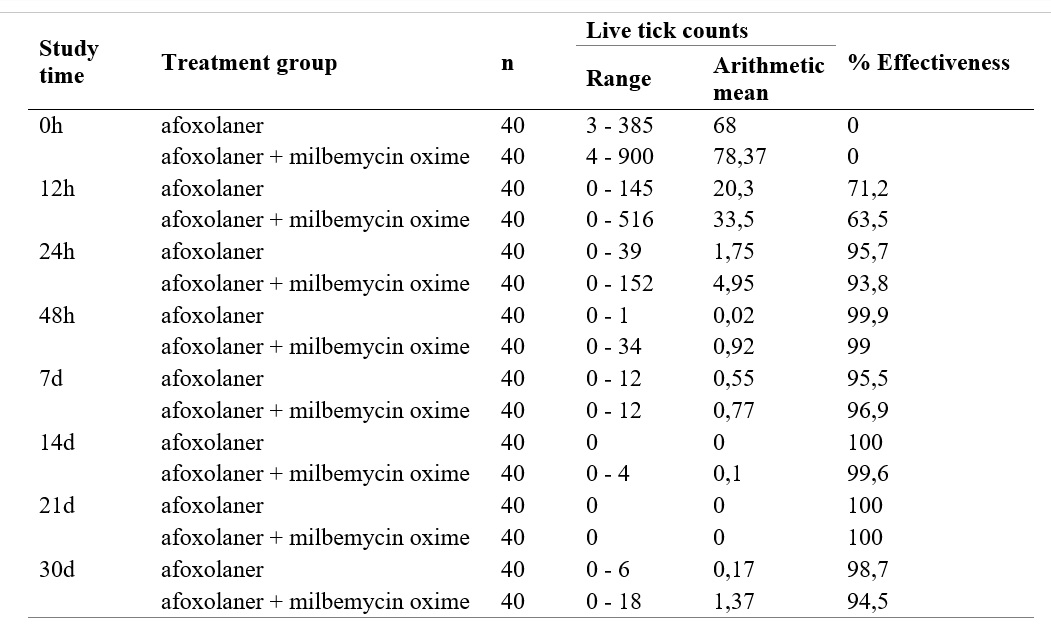
Cuando se evalúa la efectividad del grupo A y B a las 12 horas, se puede encontrar valores del 71.2 y 63.5% respectivamente, sin diferencia estadística significativa para cada grupo, mientras que a las 24 horas la efectividad del grupo A es de 95.7%, en tanto que el grupo B mostró efectividad de 93.8%. Pero a las 48 horas posteriores al tratamiento con afoxolaner, la MA de garrapatas vivas fue < 0.02 en el grupo A, y para el grupo tratado con afoxolaner + milbemicina oxima fue < 0.92, lo que indicó una eficacia en los dos grupos superior al 99%, para el día 7 la efectividad fue de 99.3 % y 99.1% respectivamente.
Ambos grupos A y B, mantuvieron la efectividad por encima del 90% durante 30 días, sin diferencia estadística significativa (p≤0.05) y pese a las reinfestaciones en diferentes grupos de animales para algunas zonas de Colombia, la eficacia general no se halló por debajo de 98.3% a partir de las 48 horas (Fig 3,4). Se evaluó de manera individual la reducción de garrapatas y se encontró que más del 90% de los perros tubo una eficacia superior al 97.6% frente a los dos tratamientos.
Discusión
La media aritmética de los conteos de garrapatas para el tiempo 0 (pre tratamiento) fue de 68 para el grupo A, y para el grupo B fue 78.37 siendo superior a lo reportado por otros autores (Becskei et al., 2016; Beugnet et al., 2015; Six et al., 2016) dado las condiciones de albergue. Por otro lado, un reporte de perros naturalmente infestados por Rhipicephalus sanguineus s.l. en Tailandia mostró una MA >800 en un grupo seleccionado arbitrariamente por su severa carga de garrapatas (Tinkruejeen et al., 2019). Pero no se encontró diferencia estadística significativa entre el grupo que recibe afoxolaner y el que recibe afoxolaner más milbemicina oxima, lo que permite comparar ambos grupos en las mismas condiciones; otros autores trabajaron con grupos de 50 garrapatas en condiciones de laboratorio (Beugnet et al., 2015; Six et al., 2016), lo que hace diferente a las condicones del presente, que es exposición en situación de campo.
La garrapata marrón del perro Rhipicephalus sanguineus s.l. es la garrapata de mayor presentación en perros en todo el mundo, disminuir el tiempo de contacto entre las garrapatas y los perros ha demostrado reducir el riego de transmisión de hemoparásitos tales como; Babesia spp., Hepatozoon canis, Ehrlichia canis, Anaplasma platys y también Haemobartonella spp (Beugnet et al., 2014; Day, 2011; Geurden et al., 2018; Giannelli et al., 2017; Otranto et al., 2009; Patra et al., 2020; Sheldon et al., 2010); lo cual pudo observarse en el presente estudio, en el cual dentro de las primeras 24 horas se había alcanzado una efectividad superior al 90%, tanto para Afoxolaner (NexGard®), como para Afoxolaner más milbemicina oxima (NexGard Spectra®), como lo describen Kunkle et al (2014) en los estudios en Sudáfrica y Australia para afoxolaner, donde se pudo encontrar efectividad superior al 98%, otros autores encontraron efectividades alrededor del 98,8% a las 24 horas, con la administración de afoxolaner (Mitchell et al,. 2014), pero para otra especie de garrapata como la Ixodes scapularis. En el presente estudio se encontró un promedio de efectividad a las 24 horas para afoxolaner del 97.4% y para afoxolaner más milbemicina oxima 93.8%, lo cual está establecido como aceptable según los lineamientos de European Medicines Agency (EMA) y World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P) que indican una eficacia superior al 90% a partir de las 48 horas post administración para que se considere efecto curativo (Chomel, 2011; Kondo et al., 2014; Marchiondo et al., 2013). Lo cual indica que ambos fármacos son efectivos a las 24 horas para eliminar la garrapata del perro. Pese a que el uso de acaricidas no repele las garrapatas, son de gran ayuda ya que limitan el tiempo de alimentación de las garrapatas y por lo tanto la probabilidad de transmisión de los hemoparásitos, lo que puede repercutir el riesgo de transmisión de enfermedades transmitidas por vectores a los seres humanos, convirtiéndolo en un problema de interés en salud pública (Baneth, 2014; Chomel, 2011; Dantas-Torres, 2010; Geurden et al., 2018; Littman et al., 2018; Maggi & Krämer, 2019) y aunque la máxima efectividad se logró para ambos productos a las 24 horas, hemoparásitos como Babesia canis y Hepatozoon canis, pueden ser prevenidos con el usos de afoxolaner o afoxolaner más milbemicina oxima, como lo describe Beugnet et al, (2014); aunque bacterias como Ehrlichia canis, Anaplasma platys y Haemobartonella sp, son transmitidas antes de las 24 horas, probablemente el uso continuo de estos productos pueden disminuir la posibilidad de infección.
Este estudio experimental demostró la eficacia que tiene afoxolaner y afoxolaner más milbemicina oxima en condiciones de infestación natural de garrapatas en trópico bajo, siendo superior al 93.8% por al menos 30 días, lo que concuerda con lo reportado previamente en estudios similares (Becskei et al., 2016; Dumont et al., 2014; Forster et al., 2021; Kunkle et al., 2014). A pesar de que algunos perros se reinfestaron en el albergue dado a las altas cargas de garrapatas en las condiciones que se hallaban, no se encontró una eficacia inferior al 90% de manera general. Un individuo mostró una menor eficiencia en el grupo B en la zona de Villavicencio, Meta a las 24 h (T2), de 85.7%, sin embargo, no modificó la eficiencia de manera general menor a 93,8%.
La asociación de afoxolaner y milbemicina oxima brinda un amplio espectro de protección frente a los patógenos más prevalentes en animales de compañía como lo son las pulgas, garrapatas y nemátodos, de acuerdo con el Tropical Council for Companion Animal Parasites (TROCCAP) se recomienda una desparasitación mensual para prevenir la infestación de endo y ectoparásitos (Dantas-Torres et al., 2020).
No se tuvo la comparación con un grupo control, lo que impidió conocer si la población de garrapatas era vigorosa e infestiva, sin embargo los resultados de conteos de garrapatas en ocasiones superiores a conteos previos de algunos animales indicó que existían altas cargas de garrapatas en los albergues donde se encontraban los perros (Marchiondo et al., 2013).
Como conclusión, los resultados de este estudio multicéntrico demostraron que el uso de afoxolaner o afoxolaner + milbemicina oxima proveen una óptima efectividad, >93.8% frente a Rhipicephalus sanguineus sensu lato, en perros infestados naturalmente en condiciones de altas cargas parasitarias por al menos 30 d.
Bibliografía
Allen, K., Little, S., Petersen, M., Gruntmeir, J., Barrett, A., Herrin, B., Starkey, L., Sun, F., & Guerino, F. (2020). Evaluation of oral fluralaner (Bravecto®) for efficacy against nymphs of Amblyomma americanum and Rhipicephalus sanguineus (sensu lato). Parasites and Vectors, 13(1). https://doi.org/10.1186/s13071-020-04179-y
Baneth, G. (2014). Tick-borne infections of animals and humans: A common ground. International Journal for Parasitology, 44(9), 591–596. https://doi.org/10.1016/j.ijpara.2014.03.011
Becskei, C., De Bock, F., Illambas, J., Mahabir, S. P., Farkas, R., & Six, R. H. (2016). Efficacy and safety of a novel oral isoxazoline, sarolaner (SimparicaTM) in the treatment of naturally occurring flea and tick infestations in dogs presented as veterinary patients in Europe. Veterinary Parasitology, 222, 49–55. https://doi.org/10.1016/j.vetpar.2016.02.007
Beugnet, F., Halos, L., Larsen, D., Labuschagné, M., Erasmus, H., & Fourie, J. (2014). The ability of an oral formulation of afoxolaner to block the transmission of Babesia canis by Dermacentor reticulatus ticks to dogs. Parasites and Vectors, 7(1), 1–7. https://doi.org/10.1186/1756-3305-7-283/TABLES/4
Beugnet, F., Liebenberg, J., & Halos, L. (2015). Comparative efficacy of two oral treatments for dogs containing either afoxolaner or fluralaner against Rhipicephalus sanguineus sensu lato and Dermacentor reticulatus. Veterinary Parasitology, 209(1–2). https://doi.org/10.1016/j.vetpar.2015.02.002
Boulanger, N., Boyer, P., Talagrand-Reboul, E., & Hansmann, Y. (2019). Ticks and tick-borne diseases. Médecine et Maladies Infectieuses, 49(2), 87–97. https://doi.org/10.1016/j.medmal.2019.01.007
Chomel, B. (2011). Tick-borne infections in dogs-An emerging infectious threat. Veterinary Parasitology, 179(4), 294–301. https://doi.org/10.1016/j.vetpar.2011.03.040
Dantas-Torres, F. (2010). Biology and ecology of the brown dog tick, Rhipicephalus sanguineus. In Parasites and Vectors (Vol. 3, Issue 1). https://doi.org/10.1186/1756-3305-3-26
Dantas-Torres, F., Ketzis, J., Mihalca, A. D., Baneth, G., Otranto, D., Tort, G. P., Watanabe, M., Linh, B. K., Inpankaew, T., Jimenez Castro, P. D., Borrás, P., Arumugam, S., Penzhorn, B. L., Ybañez, A. P., Irwin, P., & Traub, R. J. (2020). TroCCAP recommendations for the diagnosis, prevention and treatment of parasitic infections in dogs and cats in the tropics. In Veterinary Parasitology (Vol. 283). https://doi.org/10.1016/j.vetpar.2020.109167
Day, M. J. (2011). One health: The importance of companion animal vector-borne diseases. Parasites and Vectors, 4(1), 2–7. https://doi.org/10.1186/1756-3305-4-49
Dumont, P., Blair, J., Fourie, J. J., Chester, T. S., & Larsen, D. L. (2014). Evaluation of the efficacy of afoxolaner against two European dog tick species: Dermacentor reticulatus and Ixodes ricinus. Veterinary Parasitology, 201(3–4), 216–219. https://doi.org/10.1016/j.vetpar.2014.02.017
EMA. (2021). Guideline for the Testing and Evaluation of the Efficacy of Antiparasitic Substances for the Treatment and Prevention of Tick and Flea Infestation in Dogs and Cats. EMEA, 31(November), 1–16.
Fankhauser, R., Hamel, D., Dorr, P., Reinemeyer, C. R., Crafford, D., Bowman, D. D., Ulrich, M., Yoon, S., & Larsen, D. L. (2016). Efficacy of oral afoxolaner plus milbemycin oxime chewables against induced gastrointestinal nematode infections in dogs. Veterinary Parasitology, 225, 117–122. https://doi.org/10.1016/j.vetpar.2016.06.003
Forster, S., Wiseman, S., & Snyder, D. E. (2021). Field study to investigate the effectiveness and safety of a novel orally administered combination drug product containing milbemycin oxime and lotilaner (Credelio® Plus) against natural flea and tick infestations on dogs presented as veterinary patients . Parasites and Vectors, 14(1), 1–12. https://doi.org/10.1186/s13071-021-04808-0
Gassel, M., Wolf, C., Noack, S., Williams, H., & Ilg, T. (2014). The novel isoxazoline ectoparasiticide fluralaner: Selective inhibition of arthropod γ-aminobutyric acid- and l-glutamate-gated chloride channels and insecticidal/acaricidal activity. Insect Biochemistry and Molecular Biology, 45(1). https://doi.org/10.1016/j.ibmb.2013.11.009
Geurden, T., Becskei, C., Six, R. H., Maeder, S., Latrofa, M. S., Otranto, D., & Farkas, R. (2018). Detection of tick-borne pathogens in ticks from dogs and cats in different European countries. Ticks and Tick-Borne Diseases, 9(6), 1431–1436. https://doi.org/10.1016/j.ttbdis.2018.06.013
Giannelli, A., Capelli, G., Joachim, A., Hinney, B., Losson, B., Kirkova, Z., René-martellet, M., Papadopoulos, E., Farkas, R., Napoli, E., Brianti, E., Tamponi, C., Varcasia, A., Margarida, A., Madeira, L., Carvalho, D., Cardoso, L., Maia, C., Mircean, V., … Otranto, D. (2017). Lungworms and gastrointestinal parasites of domestic cats : a European perspective. International Journal for Parasitology, 47(9), 517–528. https://doi.org/10.1016/j.ijpara.2017.02.003
Gray, J., Dantas-Torres, F., Estrada-Peña, A., & Levin, M. (2013). Systematics and ecology of the brown dog tick, Rhipicephalus sanguineus. In Ticks and Tick-borne Diseases (Vol. 4, Issue 3). https://doi.org/10.1016/j.ttbdis.2012.12.003
Halos, L., Baneth, G., Beugnet, F., Bowman, A. S., Chomel, B., Farkas, R., Franc, M., Guillot, J., Inokuma, H., Kaufman, R., Jongejan, F., Joachim, A., Otranto, D., Pfister, K., Pollmeier, M., Sainz, A., & Wall, R. (2012). Defining the concept of “tick repellency” in veterinary medicine. In Parasitology (Vol. 139, Issue 4, pp. 419–423). https://doi.org/10.1017/S0031182011002228
Hampel, V., Knaus, M., Schäfer, J., Beugnet, F., & Rehbein, S. (2018). Treatment of canine sarcoptic mange with afoxolaner (NexGard®) and afoxolaner plus milbemycin oxime (NexGard Spectra®) chewable tablets: Efficacy under field conditions in Portugal and Germany. Parasite, 25. https://doi.org/10.1051/parasite/2018064
Kondo, Y., Kinoshita, G., Drag, M., Chester, T. S., & Larsen, D. (2014). Evaluation of the efficacy of afoxolaner against Haemaphysalis longicornis on dogs. Veterinary Parasitology, 201(3–4). https://doi.org/10.1016/j.vetpar.2014.02.019
Kunkle, B., Daly, S., Dumont, P., Drag, M., & Larsen, D. (2014). Assessment of the efficacy of orally administered afoxolaner against Rhipicephalus sanguineus sensu lato. Veterinary Parasitology, 201(3–4). https://doi.org/10.1016/j.vetpar.2014.02.018
Lahm, G. P., Cordova, D., Barry, J. D., Pahutski, T. F., Smith, B. K., Long, J. K., Benner, E. A., Holyoke, C. W., Joraski, K., Xu, M., Schroeder, M. E., Wagerle, T., Mahaffey, M. J., Smith, R. M., & Tong, M. H. (2013). 4-Azolylphenyl isoxazoline insecticides acting at the GABA gated chloride channel. Bioorganic and Medicinal Chemistry Letters, 23(10). https://doi.org/10.1016/j.bmcl.2013.03.031
Littman, M. P., Gerber, B., Goldstein, R. E., Labato, M. A., Lappin, M. R., & Moore, G. E. (2018). ACVIM consensus update on Lyme borreliosis in dogs and cats. Journal of Veterinary Internal Medicine, 32(3). https://doi.org/10.1111/jvim.15085
Maggi, R. G., & Krämer, F. (2019). A review on the occurrence of companion vector-borne diseases in pet animals in Latin America. In Parasites and Vectors (Vol. 12, Issue 1). https://doi.org/10.1186/s13071-019-3407-x
Marchiondo, A. A., Holdsworth, P. A., Fourie, L. J., Rugg, D., Hellmann, K., Snyder, D. E., & Dryden, M. W. (2013). World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) second edition: Guidelines for evaluating the efficacy of parasiticides for the treatment, prevention and control of flea and tick infestations on dogs and cats. Veterinary Parasitology, 194(1), 84–97. https://doi.org/10.1016/j.vetpar.2013.02.003
Otranto, D., Dantas-Torres, F., & Breitschwerdt, E. B. (2009). Managing canine vector-borne diseases of zoonotic concern: part one. In Trends in Parasitology (Vol. 25, Issue 4). https://doi.org/10.1016/j.pt.2009.01.003
Packianathan, R., Hodge, A., Bruellke, N., Jackson, C., & Maeder, S. (2020). Efficacy of combination products containing sarolaner, moxidectin and pyrantel (Simparica TrioTM) or afoxolaner and milbemycin (NexGard Spectra®) against induced infestations of Ixodes holocyclus in dogs. Parasites and Vectors, 13(1). https://doi.org/10.1186/s13071-020-04323-8
Patra, G., Sahara, A., Ghosh, S., Behera, P., Borthakur, S. K., Biswas, P., Debbarma, A., & Sahanawaz Alam, S. (2020). Prevalence of tick-borne pathogens in domestic dogs in North-Eastern region of India. Biological Rhythm Research, 51(2). https://doi.org/10.1080/09291016.2018.1526495
Pfister, K., & Armstrong, R. (2016). Systemically and cutaneously distributed ectoparasiticides: A review of the efficacy against ticks and fleas on dogs. In Parasites and Vectors (Vol. 9, Issue 1). https://doi.org/10.1186/s13071-016-1719-7
Romero-Núñez, C., Bautista-Gómez, L. G., Sheinberg, G., Martín-Cordero, A., Flores-Ortega, A., & Heredia-Cárdenas, R. (2020). Efficacy of afoxolaner plus milbemycin oxime and afoxolaner alone as treatment for sarcoptic mange in naturally infested dogs. Canadian Journal of Veterinary Research, 84(3), 212–216.
Sheldon, I. M., Lewis, G. S., Leblanc, S., & Gilbert, R. O. (2010). Defining postpartum uterine disease in cattle. 65(2006), 1516–1530. https://doi.org/10.1016/j.theriogenology.2005.08.021
Shoop, W. L., Hartline, E. J., Gould, B. R., Waddell, M. E., McDowell, R. G., Kinney, J. B., Lahm, G. P., Long, J. K., Xu, M., Wagerle, T., Jones, G. S., Dietrich, R. F., Cordova, D., Schroeder, M. E., Rhoades, D. F., Benner, E. A., & Confalone, P. N. (2014). Discovery and mode of action of afoxolaner, a new isoxazoline parasiticide for dogs. Veterinary Parasitology, 201(3–4). https://doi.org/10.1016/j.vetpar.2014.02.020
Six, R. H., Young, D. R., Myers, M. R., & Mahabir, S. P. (2016). Comparative speed of kill of sarolaner (SimparicaTM) and afoxolaner (NexGard®) against induced infestations of Ixodes scapularis on dogs SimparicaTM: Comparative Efficacy of sarolaner, a novel oral ectoparasiticide for dogs. Parasites and Vectors, 9(1). https://doi.org/10.1186/s13071-016-1307-x
Tielemans, E., Pfefferkorn, A., & Viljoen, A. (2021). Efficacy of a novel topical combination of esafoxolaner, eprinomectin and praziquantel against Rhipicephalus sanguineus in cats. Parasite, 28, 24. https://doi.org/10.1051/parasite/2021020
Tinkruejeen, G., Meesaimongkon, P., Tangtrongsup, S., Thitaram, N., Srifawattana, N., Beugnet, F., & Tiwananthagorn, S. (2019). Comparative efficacy of afoxolaner and ivermectin in dogs naturally infested with Rhipicephalus sanguineus sensu lato: A clinical field study conducted in Thailand. Veterinary Parasitology: Regional Studies and Reports, 18(September), 100340. https://doi.org/10.1016/j.vprsr.2019.100340









